Ich werde versuchen, diese Fragen aus verschiedenen Ansichten zu beantworten.
Makroskopische Ansicht
Der "quantitative" und nicht der qualitative Unterschied in einem Flüssig-Gas-Phasenübergang beruht auf der Tatsache, dass sich die Anordnung der Moleküle nicht so stark ändert (es gibt keinen qualitativen Unterschied), aber der Wert der Kompressibilität sich stark ändert (quantitativ) Unterschied). Dies ist in den Van-der-Waals-Isothermen unterhalb der kritischen Temperatur
leicht zu erkennen
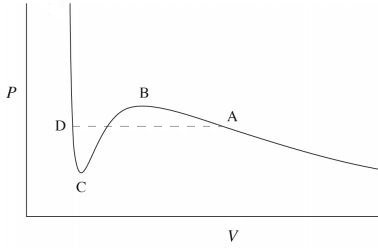
Der Phasenübergang erfolgt an der gestrichelten Linie $ AD $. Bei Volumina kleiner als $ V_D $ bedeutet die hohe Steigung der Kurve, dass man einen großen Druck benötigt, um eine kleine Menge Volumen zu verringern. Dies kennzeichnet eine flüssige Phase, die eine sehr geringe Kompressibilität aufweist. Denn die Steigung ist viel geringer und die Kompressibilität hoch, was ein Gas auszeichnet. Zwischen $ V_D $ und $ V_A $ gibt es eine gemischte Phase, die durch eine divergierende Kompressibilität gekennzeichnet ist, d. H. Das Volumen ändert sich bei konstantem Druck.
Oberhalb der kritischen Temperatur ändert sich die Kompressibilität nicht mehr so radikal. Die Van-der-Waals-Isotherme ist die folgende
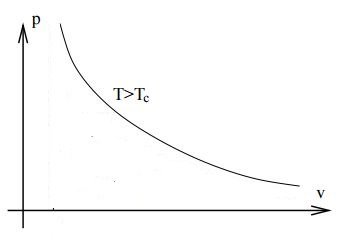
Wie Sie bereits erwähnt haben, nimmt die Dichte mit dem Druck kontinuierlich zu. Sie können auch aus der Van der Waals-Gleichung ersehen, wenn geschrieben als
$$ p = \ frac {NkT} {V-Nb} -a \ frac {N ^ 2} {V ^ 2}, $$
dass es sich bei sehr hohen Temperaturen so verhält
$$ p \ rightarrow \ frac {NkT} {V-Nb}, $$
was sich qualitativ nicht von einer idealen Gasisotherme unterscheidet. Es gibt keine flüssige Phase.
Mikroskopische Ansicht
Betrachten wir einen Stoff unterhalb seiner kritischen Temperatur.Nach einem Phasenübergang von Gas zu Flüssigkeit erscheint ein Meniskus (Grenzfläche) zwischen dem Flüssigkeitsabschnitt und einem Dampfabschnitt (Gasabschnitt), der aufgrund der kinetischen Verteilung der Geschwindigkeiten vorhanden ist.Der Dampf hat eine viel geringere Dichte, so dass ein Molekül in der Masse der Flüssigkeit mehr Bindungen aufweist als ein Molekül in der Oberfläche (Grenzfläche).Jede Bindung hat eine negative Bindungsenergie (Bindungszustände), so dass die Moleküle in der Oberfläche einen Energieüberschuss aufweisen.
Dies führt zu einer (positiven) Oberflächenenergiedichte, die nichts anderes als die Oberflächenspannung der Grenzfläche ist.Wenn wir die Temperatur erhöhen, steigt die Dampfdichte und irgendwann entspricht sie der Flüssigkeitsdichte.Zu diesem Zeitpunkt ist die Anzahl der Bindungen für die Moleküle in der Masse und in der Oberfläche gleich, so dass keine Oberflächenspannung vorliegt.Dies bedeutet, dass es keinen Meniskus und keinen Phasenübergang gibt.Es muss daher einen kritischen Punkt geben.