Die anderen Antworten sind richtig, aber ich denke, dass Sie von einer "mikroskopischeren" Sicht auf das, was hier passiert, profitieren könnten.
Immer wenn sich eine Substanz (ein gelöster Stoff) in einer anderen (einem Lösungsmittel) löst Was auf molekularer Ebene passiert, ist, dass die gelösten Moleküle von den Lösungsmittelmolekülen umgeben sind.
Was verursacht das? Wie @Chris beschrieben hat, gibt es zwei Prinzipien: Thermodynamik und Kinetik .
In einfachen Worten könnte man sich Thermodynamik als Antwort vorstellen auf die Frage "Wie viel wird sich auflösen, wenn ich unendlich lange warte?", während die Kinetik die Frage beantwortet, "wie lange muss ich warten, bis sich die X-Menge auflöst." Beide Fragen sind auf makroskopischer Ebene (unserer Welt) normalerweise nicht leicht zu beantworten, aber beide unterliegen zwei sehr leicht verständlichen Prinzipien auf mikroskopischer Ebene (der Welt der Moleküle): Potenzial und kinetische Energie .
Potentielle Energie
Auf der makroskopischen Skala denken wir normalerweise nur an die potentielle Gravitationsenergie - das Feld, das für die Schwerkraft verantwortlich ist. Wir sind es gewohnt, an Objekte zu denken, die hoch über der Erdoberfläche liegen und bei Gelegenheit auf die Erde fallen. Wenn ich Ihnen ein Bild von einem Felsen zeige, der auf der Erdoberfläche sitzt:
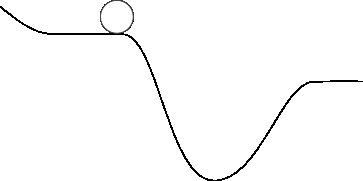
Und dann fragen Sie: "Wohin geht der Felsen?" Sie haben eine ziemlich gute Idee: Es wird bis zum tiefsten Punkt gehen (wir schließen hier Reibung ein).
Auf der mikroskopischen Skala sind Gravitationsfelder extrem schwach, aber an ihrer Stelle haben wir elektrostatische potentielle Energiefelder. Diese sind in dem Sinne ähnlich, dass die Dinge versuchen, sich von einer Energie mit hohem Potential zu einer Energie mit niedrigerem Potential zu bewegen, aber mit einem entscheidenden Unterschied: Sie können negative und positive Ladungen haben, und wenn Ladungen das entgegengesetzte Vorzeichen haben, ziehen sie sich gegenseitig an und wann Sie haben das gleiche Zeichen, sie stoßen sich gegenseitig ab.
Nun sind die Details, wie jedes einzelne Molekül eine bestimmte Ladung erhält, ziemlich kompliziert, aber wir können nur eines verstehen:
Alle Moleküle haben eine attraktive potentielle Energie zwischen sich, aber die Größe dieser potentiellen Energie variiert stark. Beispielsweise ist die Kraft zwischen dem Wasserstoffatom auf ein Wassermolekül ( $ H_2O $ span>) und dem Sauerstoffatom auf einem anderen Wassermolekül ungefähr 100-mal stärker als die Kraft zwischen zwei Sauerstoffmoleküle ( $ O_2 $ span>). Dies liegt daran, dass die Ladungsdifferenz an Wassermolekülen viel größer ist (etwa 100-mal) als die Ladungsdifferenz an Sauerstoffmolekülen.
Dies bedeutet, dass wir uns die potenzielle Energie zwischen zwei Atomen immer als etwas vorstellen können, das etwas aussieht wie folgt:
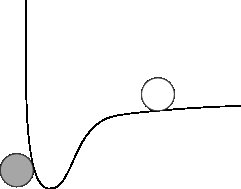
Das "Geister" -Partikel repräsentiert ein stationäres Atom, und die Linie repräsentiert die potentielle Energie "Oberfläche", die ein anderes Atom sehen würde. In diesem Diagramm können Sie hoffentlich sehen, dass das sich bewegende Atom dazu neigt, in Richtung des stationären Atoms zu fallen, bis es es gerade berührt und an diesem Punkt aufhört. Da alle Atome eine Anziehungskraft zwischen sich haben und nur die Größe variiert, können wir dieses Bild im Kopf behalten und einfach die Tiefe der potentiellen Energie "gut" ändern, um die Kräfte stärker oder schwächer zu machen .
Kinetische Energie
Lassen Sie uns die erste potenzielle Energieoberfläche ein wenig modifizieren:
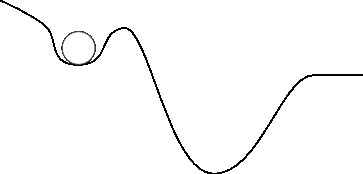
Wenn ich jetzt frage "Wohin geht der Stein?", ist es etwas schwieriger zu antworten. Der Grund ist, dass man erkennen kann, dass der Felsen im ersten kleinen Tal "gefangen" ist. Intuitiv können Sie wahrscheinlich sehen, dass es, wenn es eine gewisse Geschwindigkeit oder kinetische Energie hätte, aus dem ersten Tal entkommen und im zweiten landen würde. Wenn Sie so darüber nachdenken, können Sie auch sehen, dass bereits im ersten Bild ein bisschen kinetische Energie benötigt wird, um sich zu bewegen. Sie können auch sehen, dass, wenn eines der Gesteine viel kinetische Energie hat, es tatsächlich am tieferen Tal vorbeiführt und irgendwo hinter der rechten Seite des Bildes landet.
Was Wir können daraus ableiten, dass potenzielle Energieoberflächen den Gebrauch angeben, wohin wollen (ich verwende den Begriff sehr locker), während kinetische Energie uns sagt, ob sie in der Lage sind um dorthin zu gelangen.
Schauen wir uns ein anderes mikroskopisches Bild an:
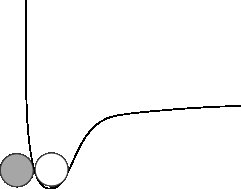
Jetzt haben die Atome von früher ihre niedrigste potentielle Energie. Damit sie auseinanderfallen, müssen Sie ihnen kinetische Energie geben.
Wie geben wir Atomen kinetische Energie? Durch Erhöhen der Temperatur . Die Temperatur steht in direktem Zusammenhang mit der kinetischen Energie - mit steigender Temperatur steigt auch die durchschnittliche kinetische Energie jedes Atoms und Moleküls in einem System.
Inzwischen können Sie dies möglicherweise Ratet mal, wie eine Erhöhung der Wassertemperatur zu einer effektiveren Reinigung beiträgt, aber schauen wir uns einige Details an, um sicherzugehen.
Löslichkeit
Wir können das mikroskopische Bild von potenziellen und kinetischen Energien machen und extrahieren Sie zwei wichtige Richtlinien daraus:
- Alle Atome sind "klebrig", obwohl einige klebriger sind als andere.
- Höhere Temperaturen bedeuten, dass Atome größere kinetische Energien haben
ol> Zurück zur Frage der Kaffeetasse. Jetzt müssen wir nur noch darüber nachdenken, wie sich diese mit den bestimmten Molekülen auswirken, die Sie betrachten.
Kaffee ist eine Mischung aus vielen verschiedenen Dingen - Ölen, wasserlöslichen Verbindungen, verbrannten Kohlenwasserstoffen (für eine alte Kaffeetasse) usw. Jedes dieser Dinge hat eine andere "Klebrigkeit". Öle sind überhaupt nicht sehr klebrig - die Anziehungskräfte zwischen ihnen sind ziemlich schwach. Wasserlösliche Verbindungen sind sehr "klebrig" - sie ziehen sich stark an, weil sie große Ladungen haben. Da Wassermoleküle auch große Ladungen haben, sind wasserlösliche Verbindungen wasserlöslich - sie haften leicht an Wasser. Verbrannte Kohlenwasserstoffe sind nicht sehr klebrig, ähnlich wie Öle.
Da Moleküle mit großen Ladungen dazu neigen, an Wassermolekülen zu haften, nennen wir sie hydrophil - was bedeutet, dass sie Wasser "lieben" . Moleküle ohne große Ladungen werden als hydrophob bezeichnet - sie "fürchten" Wasser. Obwohl der Name darauf hindeutet, dass sie von Wasser abgestoßen werden, ist es wichtig zu wissen, dass es tatsächlich keine Abstoßungskräfte zwischen Wasser und hydrophoben Verbindungen gibt - es ist nur so, dass Wasser sich so sehr mag, dass die hydrophoben Verbindungen ausgeschlossen sind und aneinander haften
Wenn wir zur schmutzigen Kaffeetasse zurückkehren und Wasser hinzufügen und mit dem Schrubben beginnen, passiert eine Reihe von Dingen:
Hydrophile Verbindungen
Hydrophile Verbindungen lösen sich schnell in Wasser auf, da sie ziemlich gut an Wasser haften, verglichen damit, wie gut sie aneinander und an der Tasse haften. In dem Fall, in dem sie besser aneinander oder an der Tasse haften als Wasser, ist der Unterschied nicht groß, so dass nicht viel kinetische Energie erforderlich ist, um sie ins Wasser zu bringen. Durch warmes Wasser lösen sie sich leichter auf.
Hydrophobe Verbindungen
Hydrophobe Verbindungen (Öle, verbranntes Material, die meisten Flecken) haften nicht am Wasser. Sie haften ein wenig aneinander (denken Sie daran, dass die Kräfte im Vergleich zu Wasser viel schwächer sind, da die Ladungen sehr gering sind), aber Wasser haftet so gut an sich selbst, dass die Öle keine Chance haben, zwischen die Wassermoleküle zu gelangen. Wir können sie schrubben, was genug Energie liefert, um sie loszuwerden und das Wasser sie wegtragen zu lassen, aber wenn wir auch die kinetische Energie durch Erhöhen der Wassertemperatur erhöhen würden, könnten wir beide schwächeren Kräfte überwinden, die das Hydrophob halten Verbindungen zusammen, während gleichzeitig den Wassermolekülen mehr Beweglichkeit verliehen wird, damit sie sich auseinander bewegen und die hydrophoben Verbindungen einlassen können. Wärmeres Wasser erleichtert daher auch das Abwaschen hydrophober Verbindungen.
Makroskopisch Ansicht
Wir können dies auf die ursprüngliche Diskussion zwischen Thermodynamik und Kinetik zurückführen. Wenn Sie die Wassertemperatur erhöhen, lautet die Antwort auf die Frage "Wie viel löst sich auf" "mehr". (Das war der thermodynamische Teil). Die Antwort auf "Wie lange wird es dauern" lautet "nicht so lange" (Kinetik).
Und wie @anna sagte, gibt es andere Dinge, die Sie tun können, um es noch einfacher zu machen. Seife besteht zum Beispiel aus langkettigen Molekülen mit einem geladenen Ende und einem ungeladenen Ende. Dies bedeutet, dass ein Ende hydrophil ist, während das andere Ende hydrophob ist. Wenn Sie dem Bild Seife hinzufügen, geht das hydrophile Ende ins Wasser, während das hydrophobe Ende versucht, die Öle und das verbrannte Material zu umgeben. Das Nettoergebnis sind kleine "Blasen" (als Mizellen bezeichnet), die aus Seifenmolekülen bestehen, die hydrophobe Moleküle umgeben, die wiederum von Wasser umgeben sind.